
扫描二维码,关注微信公众号
医疗器械软件产品技术要求的编写
医电室:朱鹏志、周恒艳、赵嘉宁
医疗器械软件包括本身预期作为医疗器械的软件(独立软件)和作为医疗器械内部组成部分的软件(软件组件)。随着科学技术的不断发展以及计算机和嵌入式系统的广泛应用,医疗器械软件几乎无处不在,发挥的作用也越来越大。但其质量问题也不容忽视——美国FDA召回数据表明含有软件的医疗器械召回原因有33.7%与软件有关,因此对医疗器械软件的监管成为当前的热点之一。
2015年8月,国家食品药品监督管理总局发布了《医疗器械软件注册技术审查指导原则》,用于指导制造商提交医疗器械软件注册申报资料,同时规范医疗器械软件的技术审评要求。指导原则针对软件的特殊性,在现行法规要求下进一步明确了对医疗器械软件的要求,特别是对软件更新、软件版本升级的要求。指导原则包括范围、基本原则、软件描述文档、软件更新、软件版本、现成软件、注册申报资料要求等内容,并将独立软件产品技术要求模板作为附录列出。
然而,附录中仅给出的独立软件产品技术要求条款的推荐性架构,并无详细的解释和阐述,很多企业在编制过程中遇到了一些问题,本文将根据笔者的检验经验对这些问题进行总结归纳,从而对医疗器械软件产品技术要求编写的一些重点和难点提出一些建议。
一、软件版本
软件没有物理实体,只能通过状态管理保证质量,而软件版本用于标识软件状态,控制软件更新,进而保证软件质量,因此软件版本与软件是相互对应的表里关系,即软件版本是软件标识不可或缺的组成部分,也是实现医疗器械软件可追溯性的重要工具。然而,部分企业对软件版本的重要性认识不足,甚至存在误区,最终导致不利于自身对软件的管理以及国内医疗器械软件监管工作的开展。以下将针对几点误区进行解析:
1. 嵌入式软件组件没有软件版本
很多企业认为嵌入式软件的所有功能基本依靠硬件实现,软件仅为辅助作用,所以在编制产品技术要求时没有明确嵌入式软件的版本,结果导致被技术审评中心发补。其实,独立软件和软件组件尽管在结构和功能上有所不同,风险情况也不尽相同,但软件生存周期过程基本一致,故二者注册申报资料要求的基本原则相同,需公布其发布版本和完整版本,以便于监管。
2. 软件版本命名规则可根据自己喜好随意编排
制造商无论采用何种名称和形式(如修订号、构建号、发布日期等),只要用于标识软件状态均可视为软件版本。然而,制造商制定软件版本命名规则不仅要考虑医疗器械产品自身特点和质量管理体系要求,也要考虑国家监管的要求,即软件版本命名规则能够区分软件更新类型,可以确认软件完整版本和软件发布版本。例如,有些企业在命名版本时以年月日为版本号,那么一旦在不同时段进行了微小改动,就需要更改版本号。这样,一方面会造成企业会有大量的软件版本需要管理,另一方面也因无法区分软件更新类型而给监管部门制造困难。
另外,软件版本命名规则实际针对软件完整版本的说明,以便于区分字段变化对应发生的更新类型。
3. 软件发布版本和完整版本没有区分
根据审评指导原则要求,软件完整版本应能体现重大增强类软件更新、轻微增强类软件更新、纠正类软件更新和构建(如适用);软件发布版本应为软件发行所用的标识版本,仅体现重大增强类软件更新(即重大软件更新)。软件发布版本发生改变应进行许可事项变更,软件完整版本发生改变但软件发布版本未变无需进行注册变更。
有些企业在产品技术要求的发布版本一项保留了完整版本的所有字段。那么当根据版本命名规则,发生纠正类软件更新或构建而导致软件版本变更时,根据监管要求,企业当申报许可事项变更,从而导致本可以依靠企业自身管理体系完成的事项,必须报备相关政府部门,无形增加了自己的时间成本和经济成本。
二、性能指标及检验方法
指导原则中给出的独立软件产品技术要求的性能条款,对软件的14个方面进行了规定。首先,应明确并非所有软件都必须存在这14条相关的功能或性能,指导原则中给出的条款仅为参考,需根据产品实际情况进行编制。
其中,处理对象、最大并发数、临床功能、使用限制、版权保护、用户界面、可靠性、效率、运行环境较容易理解,大部分可参考软件的实际用途和操作手册等文档进行编制。其它几项因为其特殊性,很多企业存在疑问,下面对其进行阐述:
1. 数据接口
此处特指数据的通讯接口,有统一的编码形式或接口标准,包括软件接口和硬件接口。
如PACS软件的图像传输协议一般使用DICOM3.0(为特定的编码形式)的软件接口与影像设备通讯,应予以明确;但其硬件接口可能是网络接口,也可能是其它的接口,不必写出。
如移动软件组件,用于控制血压计充放气,并读取测量数据,其硬件接口为蓝牙,应予以明确;但其传输协议可能是在蓝牙协议基础上自定义的数据格式,不必写出。
2. 特定软硬件
此处特指需要完成临床功能所需要的医疗器械软件或硬件,不包括通用的软硬件,不应与软件的运行环境(硬件环境和软件环境)相混淆。
如Holter软件要实现对心电数据的读取和分析,必须要有支持对应型号的Holter硬件,此处应予以明确软件所支持的所有硬件型号。
3. 用户访问控制
此处应明确用户访问控制管理机制,即软件使用时分配了几种用户角色,每种用户角色对应的使用权限有哪些。
4. 消息
此处应明确在软件使用过程中会出现的消息类型,以及出现对应消息的条件。
5. 维护性
此处应明确软件所提供的维护手段,如建立日志等,并指明包括了哪些维护信息,以及查询相关信息的方法。
三、体系结构图、用户界面关系图及物理拓扑图
指导原则要求在产品技术要求的附录中明确软件的体系结构图、用户界面关系图及物理拓扑图,很多企业对这“三幅”图的概念区分不清,感觉其制作及阐述毫无头绪。以下分别对其进行解释和举例:
1. 体系结构图
随着软件工程的不断发展,软件的编程模式已从过程编程逐步转向面向对象编程,程序的模块化,不仅有利于软件的扩展,也有利于软件的维护。因此,大部分软件是由多个封装的模块组成。体系结构图即是明确软件本身到底有多少个模块,模块的分类如何(基于应用层、基于中间层、基于设备层),模块之间的关系如何,如图1。
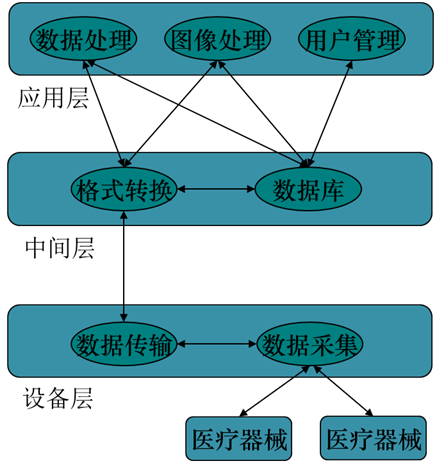
图1 体系结构图
2. 用户界面关系图
随着软件功能的不断扩展,在同一界面下完成软件的所有功能变得越来越困难,因此根据实现的临床功能是否相近,可将一些功能模块划分至同一界面下,这就需要切换至同界面进行操作处理。因此,界面之间的相互联系不但直接影响到软件的易用性,而且是进行控制管理软件的重要手段,如图2。
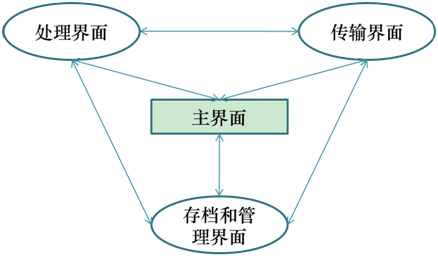
图2 用户界面关系图
3. 物理拓扑图
物理拓扑图主要用于说明软件与物理硬件之间相互关系,即需要完成整个临床功能过程中,所涉及的不同硬件,如图3。
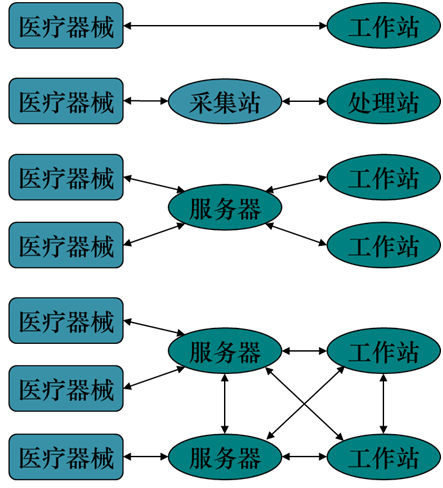
图3 物理拓扑图
目前,国际上医疗器械软件的标准体系尚不健全,也未设置专业的标准化技术委员会。我国也仅转化了4份国际标准,其中YY/T0664-2008和YY/T0708-2009为过程标准,YY0637-2008和YY0721-2009均为放射软件相关标准,体系尚未健全,不能完全满足监管需求。医疗器械软件技术要求,在一定时间内仍是软件监管的重要技术依据,具有重要意义,因此其编制应按照指导原则的要求进行。